يشير ما يسمى بصلابة الكربونات الحدية (Hj) إلى القيمة الحرجة التي لا يترسب عندها CaCO₃ في ظل ظروف ودرجات حرارة محددة لجودة المياه، حيث يكون CO₂ الحر إما غائبًا أو في حده الأدنى. وعادةً ما تتراوح هذه القيمة في أنظمة مياه التبريد من 2 إلى 4.5 ملجم مكافئ/لتر. ومع ذلك، من خلال إضافة مثبطات الأحماض والقشور، يمكن لنظام مياه التبريد الحفاظ على مستويات أعلى من صلابة الكربونات. تشرح هذه المقالة العلاقة بين مثبطات الترسبات لمياه التبريد والحد الأقصى لصلابة الكربونات، مما يوفر معلومات مفيدة لمتخصصي معالجة المياه.
1. إضافة الأحماض والحد من صلابة الكربونات
من خلال إضافة حمض إلى ماء المكياج، يتم تحويل صلابة الكربونات إلى صلابة غير كربوناتية ذات قابلية ذوبان أعلى (مثل CaSO₄ و CaCl₂)، مما يقلل من صلابة الكربونات في الماء المتداول إلى مستوى أقل من صلابة الكربونات الحدية، وبالتالي منع الترسبات. التفاعلات الكيميائية هي كما يلي:
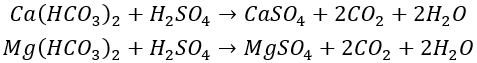
استمر في مشاركة طريقة حساب كمية الحمض المراد إضافته بناءً على صلابة الكربونات والحد الأقصى لصلابة الكربونات (Hj)، كما هو موضح في الصيغة التالية.
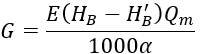
في الصيغة:
G هي كمية الحمض المضافة، كجم/ساعة؛
E هي الكتلة المولية للحمض، بالنسبة لحمض الكبريتيك، E = 49، وبالنسبة لحمض الهيدروكلوريك، E = 36.5؛
Qm هو حجم الماء الإضافي لمياه التبريد المتداولة، م³/ساعة؛
α هو تركيز الحمض؛
HB هي صلابة الكربونات في الماء التكميلي، مليمول/لتر؛
H′B هي صلابة الكربونات للمياه التكميلية بعد المعالجة الحمضية، مليمول/لتر.
يمكن حساب H′B على النحو التالي.
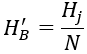
في الصيغة: N هو مضاعف التركيز؛ Hj هي صلابة الكربونات المحددة لنظام مياه التبريد المتداول، بالمليمول/لتر.
يمكن حساب الحد الأقصى لصلابة الكربونات للمياه المتداولة بعد إضافة الحمض، بدون مثبط القشور، باستخدام الصيغة التالية
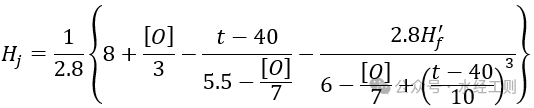
في الصيغة، يمثل [O] استهلاك الأكسجين، بوحدة ملجم/لتر؛ ويمثل t درجة حرارة الماء المتداول، بوحدة ℃.
Hf′ هي الصلابة غير الكربونية بعد المعالجة بالحمض المضاف إلى الماء الإضافي، بالمليمول/لتر، ويمكن حسابها باستخدام الصيغة التالية:
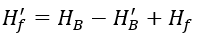
2. استخدام مثبطات الترسبات مع المعالجة الحمضية للحد من صلابة الكربونات
عند استخدام المعالجة الحمضية للحد من صلابة الكربونات بالاشتراك مع مثبطات الترسبات، يجب أن يحدد نوع مثبط الترسبات المستخدم قيمة Hj المناسبة. تشمل مثبطات الترسبات الشائعة البوليفوسفات، والفوسفونات العضوية (الأملاح)، وأحماض البولي أكريليك.
مثبطات الترسبات متعددة الفوسفات
يشير مصطلح بولي فوسفات في المقام الأول إلى بولي فوسفات الصوديوم، والأشكال المستخدمة بشكل شائع هي هيكساميتافوسفات الصوديوم (المعروف أيضًا باسم بولي ميتافوسفات الصوديوم) وثلاثي بولي فوسفات الصوديوم. تعمل هذه المثبطات على تشتيت وتثبيت الجزيئات الغروية وتتمتع بقدرات استخلاب قوية لأيونات الكالسيوم والمغنيسيوم. لا يعمل بولي فوسفات الصوديوم كمثبط للترسبات فحسب، بل يتمتع أيضًا بخصائص تثبيط التآكل. تختلف الخصائص المحددة اعتمادًا على التركيب الجزيئي لـ [NaPO₃] ن ، حيث تحدد قيمة n الخصائص. سداسي ميتافوسفات الصوديوم له الصيغة الكيميائية [NaPO₃]₆ONa₂ وهو بوليمر من ميتافوسفات الصوديوم (NaPO₃). عند استخدامه كمثبط للترسب، يمكن تقدير صلابة الكربونات المحدودة Hj للمياه المتداولة بالصيغة التالية. تتراوح الجرعة النموذجية من سداسي ميتافوسفات الصوديوم من 1 إلى 5 ملغم/لتر، مع استخدام الحد الأعلى للمياه ذات صلابة الكربونات العالية. يتمتع ترايبوليفوسفيت الصوديوم (Na₅P₃O₁₀) بقدرة قوية على خلب أيونات الكالسيوم، بجرعة نموذجية تتراوح من 2 إلى 5 مجم/لتر، وHj = 5 مليمول/لتر.
عيب متعدد الفوسفات هو ميله إلى التحلل إلى أورثوفوسفات في الماء، وهي عملية تعرف باسم التحلل المائي متعدد الفوسفات. تتأثر درجة التحلل المائي بعوامل مثل الرقم الهيدروجيني ودرجة الحرارة والوقت والنشاط الميكروبي. يرتبط التحلل المائي بشكل إيجابي بدرجة حرارة الماء ووقت التلامس، على الرغم من أنه يحدث بمعدل بطيء نسبيًا، حيث تتراوح معدلات التحلل المائي النموذجية بين 11% و35%.
الفوسفونات العضوية وأملاحها
تعتبر مثبطات الترسبات هذه فعالة وتوفر أيضًا تثبيطًا للتآكل، مما يجعلها مثبطات ذات غرض مزدوج. تتشابه العديد من خصائصها مع البوليفوسفات، ولكنها أكثر استقرارًا وأقل عرضة للتحلل المائي، حتى في درجات الحرارة المرتفعة. ومع ذلك، يمكن للفوسفونات العضوية أن تكون تآكلية للنحاس، وبالتالي فهي غير مناسبة للاستخدام في أنظمة المبادلات الحرارية النحاسية. تشتمل الفوسفونات العضوية الشائعة وأملاحها المستخدمة محليًا على حمض هيدروكسي إيثيليدين ثنائي الفوسفونيك (HEDP)، وحمض أمينوتريميثيلين فوسفونيك (ATMP)، وإيثيلين ثنائي أمين رباعي (حمض ميثيلين فوسفونيك) (EDTMP). عند استخدامها مع البوليفوسفات، يمكن أن يكون لهذه المثبطات تأثير تآزري، مما يحسن صلابة الكربونات المحدودة للمياه المتداولة ويقلل جرعة كل عامل. صلابة الكربونات المحددة النموذجية لهذه المثبطات هي كما يلي:
HEDP: Hj = 8 مليمول/لتر
ATMP: Hj = 9 مليمول/لتر
EDTMP: Hj = 8 مليمول/لتر
بوليمرات بولي كربوكسيلات
البوليمرات متعددة الكربوكسيل هي بوليمرات تحتوي على مجموعات وظيفية كربوكسيلية (مجموعات كربوكسيلية) أو مشتقات من الأحماض الكربوكسيلية. يحدد أنيون الكربوكسيل (COO⁻) خصائص هذه البوليمرات، حيث يمثل M كاتيونًا أحادي التكافؤ، أو هيدروجينًا، أو مجموعة أمين. بعد إدخالها إلى الماء، تتفكك مجموعة الكربوكسيل إلى COO⁻ وM⁺، حيث يكون COO⁻ مسؤولاً عن تثبيط الترسبات. تشتمل مثبطات مقياس البولي كربوكسيلات الشائعة المستخدمة محليًا على حمض البولي أكريليك، وبولي أكريلات الصوديوم، وبولي ميثيل ميثاكريلات، وبوليمرات مشتركة من حمض الأكريليك وأكريليت هيدروكسي بروبيل، وبوليمرات مشتركة من حمض الأكريليك والأكريلات، وبولي (حمض الماليك) المتحلل مائيًا (أنهيدريد). الجرعات النموذجية وقيم صلابة الكربونات المحددة المقابلة لها هي كما يلي:
حمض البولي أكريليك: 1–9 مجم/لتر، Hj = 5.5–10 مليمول/لتر
بولي أكريلات الصوديوم: 1–8 مجم/لتر، Hj = 5.8–9 مليمول/لتر
بولي (حمض الماليك): 1–5 مجم/لتر، Hj = 5–8.5 مليمول/لتر
ملخص
من خلال التحكم في صلابة الكربونات المحدودة في أنظمة مياه التبريد المتداولة، يمكن منع تكوين القشور. يساعد استخدام الطرق المذكورة أعلاه لحساب الجرعة المناسبة من الأحماض ومثبطات الترسب، إلى جانب صلابة الكربونات المحدودة المسموح بها للنظام في ظل ظروف تشغيل محددة، على منع مشكلات الترسب مع تقليل التكاليف الكيميائية أيضًا.
 أون
أون
 English
English 中文简体
中文简体

